Trattamento della CMT1A con PXT3003 di Pharnext: Prospettive per il 2020

Abbiamo chiesto a Pharnext, società farmaceutica francese che sta sviluppando un farmaco per il trattamento della CMT1A denominato PXT3003 quali sono le prospettive a breve/medio termine per questo cocktail di farmaci.
Trattamento della CMT1A con PXT3003 di Pharnext: di cosa si tratta?
Il PXT3003, o Syngility (papabile nome commerciale) è un potenziale farmaco basato sulla combinazione dei principi attivi baclofene, naltrexone e sorbitolo. Il razionale alla base di questa combinazione è la cosiddetta Pleoterapia, che si propone di arrivare all’azione del farmaco utilizzando più principi attivi con diverso meccanismo d’azione, per colpire da più punti un determinato bersaglio, potendo così utilizzare dosaggi più bassi.
Successivamente allo studio di Fase II, che aveva lo scopo di valutare sicurezza e tollerabilità di questo cocktail, è stata avviata una sperimentazione di Fase III: lo studio, denominato PLEO-CMT, iniziato a dicembre 2015, ha valutato la sicurezza della terapia e la sua efficacia (rispetto a placebo) su 323 pazienti. A novembre 2019 sono stati diffusi alcuni dati relativi allo studio, che mostravano un miglioramento statisticamente significativo di alcuni parametri clinici (ONLS, scala di valutazione della gravità di malati neurologici, e il tempo necessario a camminare per 10 metri).
Tuttavia, durante la sperimentazione è stato registrato un effetto inatteso, ovvero alcune formulazioni a dosaggio più elevato mostravano un deposito sul fondo del recipiente contenente i farmaci: questo evento ha costretto ad alterare le modalità di esecuzione dello studio per i partecipanti che ricevevano le dosi più alte e, per questo, la Food and Drug Administration (FDA), l’agenzia regolatoria del farmaco statunitense, ha chiesto a Pharnext di condurre un’ulteriore sperimentazione prima della presentazione della richiesta di approvazione del farmaco.
Inoltre, questa modifica del protocollo ha reso più difficile l’elaborazione dei risultati dello studio che, ad oggi, non sono stati ancora pubblicati.
Cosa sappiamo oggi della Sperimentazione con PXT3003 di Pharnext
Con un recente comunicato stampa, Pharnext ha pubblicato alcuni risultati preliminari dello studio di follow-up (proseguimento e monitoraggio) PLEO-CMT-FU, in cui a tutti i gruppi, placebo incluso, è stato somministrato il PXT3003.
Come la stessa azienda ribadisce, i dati vanno interpretati con cautela, poiché a causa del suddetto problema di formulazione è stato necessario rivelare a pazienti ed esaminatori quali pazienti prendessero il farmaco.
In generale, è visibile un significativo miglioramento dell’ONLS in tutti i gruppi, incluso quello dei pazienti che non avevano inizialmente assunto il farmaco. Sospendendo l’assunzione tra studio e follow-up, questa tendenza al miglioramento peggiora. Non è ancora noto se il miglioramento di questo indice si traduca in un miglioramento percepibile della salute e della qualità di vita dei pazienti con Charcot-Marie-Tooth.
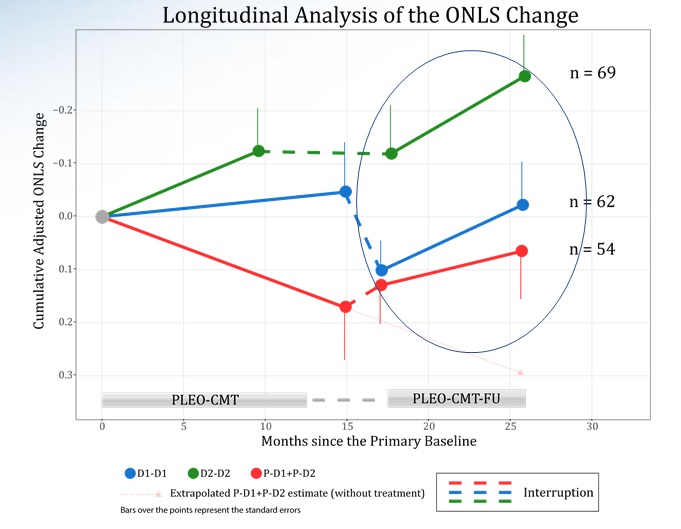
La richiesta da parte dell’FDA di ripetere una parte dello studio ha, inevitabilmente, dilatato i tempi inizialmente previsti per la pubblicazione dei risultati e la richiesta di immissione in commercio. I dati che emergeranno da questo nuovo studio, che partirà nella seconda metà del 2020, verranno usati anche per supportare la richiesta di immissione in commercio in Europa, che verrà pertanto presumibilmente posticipata.
Al momento, l’azienda conta di pubblicare i risultati dello studio completo su una rivista di alto valore scientifico (NEJM o The Lancet) entro il primo trimestre del 2020.
Per quanto concerne la sperimentazione pediatrica, lo studio sui bambini potrebbe partire in alcuni centri, che non sono stati ancora comunicati, a luglio del 2020. Per questo studio, anche l’Italia sarà coinvolta.
La partenza dello studio pediatrico è necessaria per poter ottenere l’autorizzazione all’immissione in commercio; è plausibile però che, qualora l’ente regolatore europeo EMEA (che ancora non si è pronunciato in tal senso) avanzasse la stessa richiesta dell’FDA di ripetere lo studio di fase III, l’azienda decida di posticipare l’inizio di tale sperimentazione sui bambini.
Come Associazione, ribadiamo l’atteggiamento prudente già espresso nei confronti di questa sperimentazione e attendiamo di conoscere i risultati completi dello studio.
