Sperimentazione IFB-088 sulla CMT: buoni risultati da fase I
InFlectis BioScience annuncia il completamento con successo della fase 1 della Sperimentazione IFB-088 sulla CMT: i risultati mostrano che IFB-088 è sicuro e ben tollerato in volontari sani. I dati supporteranno l’avvio dello studio di fase 2, con un piccolo gruppo di pazienti affetti da malattia di Charcot-Marie-Tooth di tipo 1A e 1B.

InFlectis BioScience SAS, una società farmaceutica con sede a Nantes, nella Francia occidentale, impegnata nello sviluppo di terapie innovative che sfruttano la risposta integrata allo stress per il trattamento di un’ampia gamma di malattie ha annunciato i risultati del suo studio di Fase 1 su IFB-088, in 72 volontari sani.
Questo tipo di studio clinico (detto di fase I) ha lo scopo di verificare quanto farmaco sia possibile somministrare prima che sia tossico in soggetti sani. I risultati di questo studio a dose singola e multipla dimostrano che la somministrazione di IFB-088 è stata sicura e ben tollerata. Nessun grave effetto collaterale , tossicità dose-limitante, o anomalia clinicamente significativa sono stati osservati. I parametri farmacocinetici erano coerenti con i dati derivati da studi approfonditi su modelli animali.
I risultati di questo studio forniscono i primi dati clinici per IFB-088 e di fatto avviano un percorso per la sua valutazione come potenziale trattamento terapeutico orale di prima classe per la CMT “, ha commentato Philippe Guédat, Ph.D., Presidente e Amministratore Delegato, InFlectis BioScience, e costituiranno la base per la richiesta di proseguimento degli studi (come farmaco orfano, con un percorso privilegiato e più rapido).
Cosa sappiamo della Sperimentazione IFB-088 sulla CMT e del principio attivo
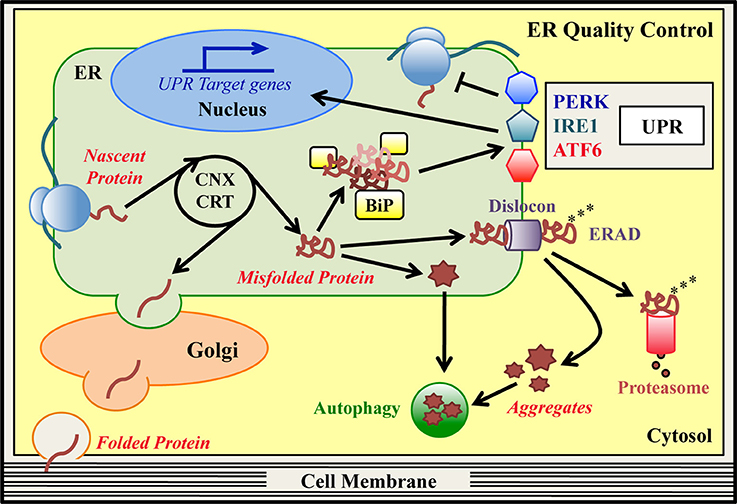
IFB-088 (noto anche come Sephin1) è un candidato farmaco disponibile per via orale, con un meccanismo d’azione validato e un promettente profilo farmacocinetico avente come bersaglio il sistema nervoso centrale e periferico. IFB-088 migliora il metabolismo delle proteine attivando una risposta integrata allo stress (ad es. accumulo di proteine mal ripiegate, stress ossidativo, ecc.) osservata in diversi disturbi neurodegenerativi, tra cui la CMT.
IFB-088 interagisce con un complesso di proteine indotto da stress coinvolto nella regolazione della produzione di nuove proteine. IFB-088 regola la velocità di traslazione delle proteine nelle cellule stressate a un livello gestibile dalle proteine cellulari disponibili che aiutano a ripiegare le proteine (i cosiddetti “chaperones”), ripristinando così la proteostasi (normale metabolismo delle proteine). L’azienda riferisce che IFB-088 è sorprendentemente specifico per le cellule stressate, evitando l’inibizione persistente della sintesi proteica in condizioni normali per cellule non stressate.
La risposta allo stress (ISR) ha importanti conseguenze patologiche legate alle malattie neurodegenerative, infiammazione e tumori. Sfruttando l’ISR mediante la modulazione farmacologica della regolazione della produzione di nuove proteine aiuta a ripristinare l’omeostasi cellulare; tale azione è stata dimostrata in modelli animali validati di Charcot-Marie-Tooth (CMT), sclerosi laterale amiotrofica (SLA) e sclerosi multipla (SM).
Al via la sperimentazione di fase II per IFB-088 sulla SLA
È al via anche in Italia, capofila l’istituto neurologico Besta di Milano, la sperimentazione di fase 2 di un nuovo promettente farmaco per la SLA, Sclerosi Laterale Amiotrofica, malattia neurodegenerativa che condivide alcuni meccanismi molecolari con la Charcot-Marie-Tooth.
Lo studio punta a valutare la sicurezza e tollerabilità di IFB-088 nonché, come endpoint secondari, la sua efficacia e eventuali biomarcatori. Le aspettative sulla possibilità di rallentare la progressione di malattia sono elevate nei ricercatori, grazie a precedenti risultati sempre di fase 2 su una molecola analoga. L’eventuale futura sperimentazione sulle persone con Charcot-Marie-Tooth è legata a doppio filo al buon esito di questo studio sulla SLA.
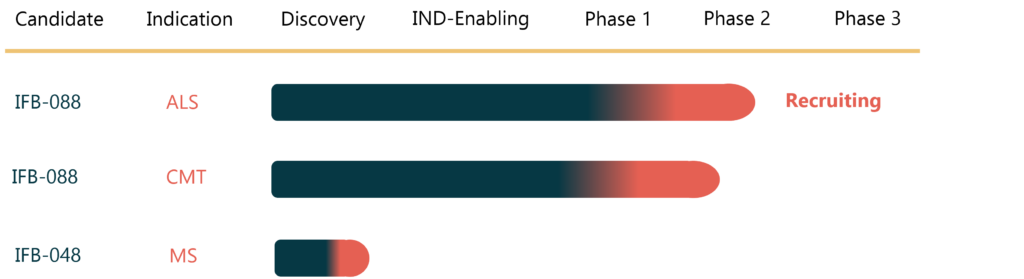
Pipeline dello sviluppo del farmaco IFB-088 nella CMT e nella SLA
Lo studio al via al Besta e in altri 16 centri clinici in Italia e in Francia è supportato da ALSA e AFM-Téléthon. La molecola in sperimentazione, IFB-088 (INN: icerguastat) o Sephin1, è in grado di modulare tre principali meccanismi fisiopatologici della SLA responsabili della progressione della malattia: aggregazione proteica, stress ossidativo ed eccitotossicità del glutammato. La speranza è di riuscire così a rallentare la progressione della malattia, grazie al miglioramento del metabolismo delle proteine, che il farmaco induce attivando una risposta integrata allo stress osservata in varie malattie neurodegenerative, come la SLA, la Charcot-Marie-Tooth e, in una sua diversa versione, la sclerosi multipla.